永利官网2015届毕业生苏楠楠以第一作者在Nature杂志上发表文章
【转自浙江大学微信公众号】生长素是最重要的植物激素,主要合成部位是芽、幼嫩的叶和发育中的种子,通过极性运输分配到植物各处组织,调控生长发育——低浓度生长素促进生长,高浓度生长素抑制生长。生长素的极性运输对生长素的分配至关重要。那么,生长素极性运输是如何实现的呢?
近日,浙江大学医学院生物物理系长聘副教授/附属第四医院双聘教授郭江涛指导的浙江大学-湖北大学联合研究团队阐明了生长素转运蛋白PIN介导生长素极性运输的分子机制。这项工作于北京时间8月2日刊登在国际顶级期刊《自然》上。该成果作为植物生长素极性运输研究的重大突破,解决了植物向性这一个百年科学难题中的关键一环,为人们进一步调控生长素极性运输奠定了基础。
19世纪末,英国著名生物学家、进化论的奠基人达尔文在研究植物向性运动时,发现植物胚芽鞘的尖端受单侧光刺激后,向下面的伸长区传递了某种“影响”,造成伸长区背光面比向光面生长快,胚芽鞘出现向光性弯曲(图1)。这就是中学生物教科书上被大家广为熟知的达尔文向光性实验。1928年,荷兰科学家温特证实胚芽鞘弯曲生长是由一类化学物质引起的,并命名为生长素(auxin)。1946年,科学家从高等植物中首次分离出生长素,其主要成分为吲哚乙酸IAA。
后续研究发现,生长素不仅与植物向光性相关,还与植物向地性(向重力性)、向化性(包括向肥性)等相关。植物受单向的环境刺激而呈现的定向反应统称为向性(tropism)。这种向性主要是由生长素在植物体内极性分配造成的。因此,生长素的极性运输在这一过程中就变得非常关键。

生长素极性运输主要依赖于三种定位于细胞膜上的转运蛋白:AUX/LAX家族蛋白、PIN家族蛋白和ABCB家族蛋白,其中生长素外排蛋白PIN起最主要作用。pin 突变体通常表现出相应组织生长素极性运输缺陷的表型,如向光性、向重力性受损等。然而,由于缺乏结构信息,人们对PIN蛋白如何介导生长素外排了解甚少。
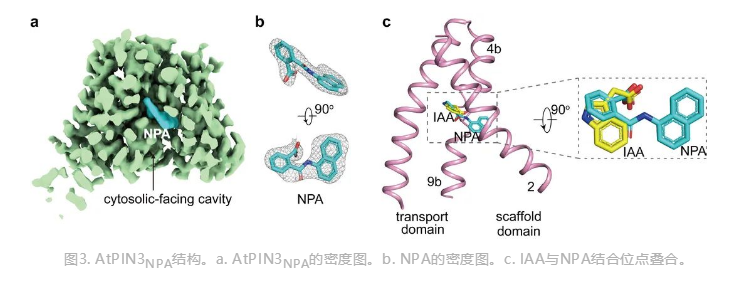
浙大研究团队利用单颗粒冷冻电镜技术,解析了拟南芥PIN3(AtPIN3)在未结合配体(AtPIN3apo)和结合IAA(AtPIN3IAA)两种状态的高分辨率结构。通过结构解析发现AtPIN3以二聚体形式存在,每个亚基包含10个跨膜螺旋(TM1–10),TM1–5和TM6–10组成反向重复结构(图2a)。AtPIN3apo与AtPIN3IAA结构类似,且均为向内开放状态。AtPIN3单体由支架结构域(scaffold domain)和转运结构域(transport domain)组成。在AtPIN3IAA结构中,IAA结合在支架结构域和转运结构域之间的内向开放口袋中(图2b),与多个保守的氨基酸发生氢键和疏水相互作用(图2c)。
为了确定IAA与AtPIN3的结合模式,研究团队建立了体外放射性3H-IAA转运体系。相比于野生型AtPIN3,结合位点突变的3H-IAA外排活性显著降低。同时通过表面等离子体共振实验,测定野生型AtPIN3与突变体对IAA的解离常数(KD )。实验表明,野生型AtPIN3与突变体相比对IAA有更高的亲和力。此外,本研究同时结合了分子动力学模拟和结构比较等方法对IAA的结合模式进行多重验证,阐明了AtPIN3对IAA的识别与转运机制。

除草剂NPA(N-1-naphthylphthalamic acid)是一种被广泛研究的生长素极性运输抑制剂。NPA处理的植株几乎跟生长素转运蛋白突变体植株pin1 的表型一模一样。长期以来,人们对NPA的作用靶点和作用机制一直存在争议。
该研究团队进一步解析了AtPIN3与抑制剂NPA复合物结构(AtPIN3NPA)(图3a,b)。研究人员同样通过体外放射性3H-IAA转运实验和表面等离子体共振实验验证了NPA的结合位点。比较AtPIN3IAA和AtPIN3NPA发现,抑制剂NPA与底物IAA的结合位点重叠(图3c)。因此,NPA为竞争性抑制剂,直接占据了PIN中生长素的结合位点,抑制了转运过程中PIN的潜在构象变化。
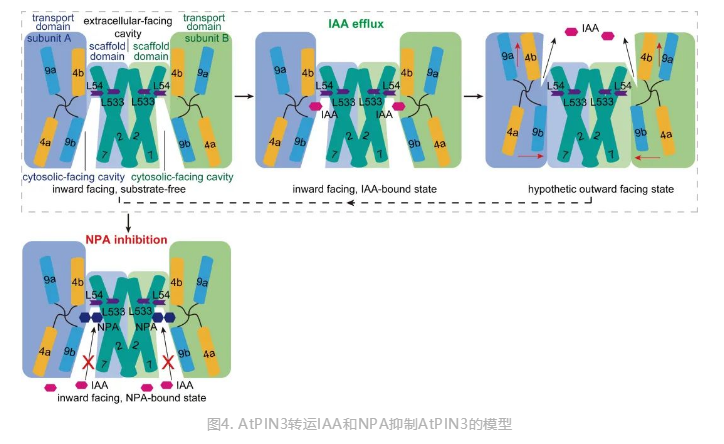
基于上述结构和活性分析,研究团队提出了PIN介导生长素转运和NPA抑制生长素极性运输的分子机制。PIN处于内向开放状态时,细胞内的IAA结合在内向开放口袋中,引起PIN二体由内向开放状态向外向开放状态转换,IAA被释放至细胞外(图4)。抑制剂NPA结合在底物结合位点,阻碍了IAA的结合,同时抑制转运过程中PIN的潜在构象变化,起到抑制生长素极性运输的效果(图4)。
该研究解析了3个AtPIN3高分辨率电镜结构,明确了底物IAA和抑制剂NPA与AtPIN3的结合模式。这项工作不仅阐明了人们长久以来期待的PIN介导生长素转运的分子机制,而且将有助于进行作物改良,指导新型PIN抑制剂的开发。这些抑制剂既可作为生长素极性运输机理研究的工具,也可作为农业除草剂,具有广泛的应用前景。
该工作是由浙江大学、湖北大学和天津大学的多个实验室联合完成(图5)。浙江大学医学院郭江涛组博士后苏楠楠、杨帆组博士生竺爱琴和湖北大学304永利集团官网入口吴姗组博士生陶鑫为论文的共同第一作者,郭江涛、吴姗和杨帆为共同通讯作者。参与这项工作的还有浙江大学304永利集团官网入口郑绍建教授和丁忠杰研究员、浙江大学冷冻电镜中心常圣海老师、浙江大学农业与生物技术学院郭逸蓉老师和张素芬老师、天津大学304永利集团官网入口叶升教授和湖北大学304永利集团官网入口马立新教授。
【校友信息】苏楠楠,女,永利官网2011级生物技术专业学生,现为浙江大学医学院博士后。
